Psicofarmacología de los trastornos del estado de ánimo
Teorías sobre la acción de los fármacos antidepresivos
Clasificaciones basadas en acciones farmacológicas agudas
Actualmente no tenemos una explicación completa y adecuada de cómo funcionan los fármacos antidepresivos. Lo que sí sabemos es que todos los antidepresivos eficaces tienen interacciones inmediatas identificables con uno o más receptores o enzimas relacionados con los neurotransmisores monoaminérgicos. Estas acciones inmediatas proporcionan el fundamento farmacológico de la actual clasificación de los diferentes antidepresivos.
Según este esquema de clasificación, existen al menos ocho mecanismos de acción farmacológicos distintos y más de dos docenas de antidepresivos. Las acciones farmacológicas inmediatas de todos los antidepresivos tienen el efecto de aumentar los niveles de los neurotransmisores monoaminérgicos a la larga.
Actualmente la investigación se centra en la expresión génica desencadenada por los antidepresivos. La hipótesis monoaminérgica de la acción de los antidepresivos en la expresión génica sugiere que dicha expresión génica constituye, en última instancia, la acción más importante de los antidepresivos.
La hipótesis de los receptores de los neurotransmisores en la acción antidepresiva
Una teoría que explica el mecanismo último de la acción terapéutica retardada de los antidepresivos es la hipótesis de los receptores de neurotransmisores en la acción antidepresiva. Como ya hemos visto, propone que la depresión está ligada a un funcionamiento anormal de los receptores de los neurotransmisores.
Tanto si los receptores de los neurotransmisores son anormales en la depresión como si no, la hipótesis de los receptores de los neurotransmisores en la acción antidepresiva propone que los antidepresivos, independientemente de cuáles sean sus acciones iniciales en los receptores y enzimas, causan finalmente una desensibilización, o regulación a la baja, de los receptores de neurotransmisores clave, siguiendo un curso temporal coherente con el inicio retardado de la acción antidepresiva de estos fármacos.
Este curso temporal coincide con otros acontecimientos, incluyendo el tiempo que necesita el paciente para hacerse tolerante a los efectos secundarios de los antidepresivos. Así, la desensibilización de algunos receptores de neurotransmisores puede llevar a las acciones terapéuticas retardadas de los antidepresivos, mientras que la desensibilización de otros receptores de neurotransmisores puede llevar con el tiempo a la disminución de los efectos secundarios.
Una visión simplista de la hipótesis de los receptores de los neurotransmisores en la depresión afirma que el estado normal se convierte en un estado de depresión cuando el neurotransmisor se agota y los receptores postsinápticos, consecuentemente, se regulan al alza. El aumento de los neurotransmisores, origina a la larga una regulación a la baja de los receptores de los neurotransmisores, siguiendo un curso temporal retardado relacionado estrechamente con la secuencia temporal de la recuperación de la depresión.
Originalmente se planteó la hipótesis de que la desensibilización de los receptores postsinápticos puede ser la responsable de las acciones terapéuticas de los antidepresivos. Hoy está claro que la desensibilización de algunos receptores postsinápticos es la responsable del desarrollo de la tolerancia a los efectos secundarios agudos de los antidepresivos.
La hipótesis monoaminérgica de la acción de los antidepresivos en la expresión génica
La hipótesis monoaminérgica de la expresión génica propone que la propia depresión se halla vinculada al funcionamiento anormal de la expresión génica inducible por neurotransmisores, especialmente factores neurotróficos como el factor neurotrófico derivado del cerebro BDNF, que llevan a la atrofia y a la apoptosis de neuronas fundamentales del hipocampo. Tanto si la transducción de un impulso neuronal monoaminérgico en la expresión génica es realmente anómala en la depresión como si no, la hipótesis monoaminérgica de la acción de los antidepresivos en la expresión génica propone que los antidepresivos, independientemente de cuáles sean sus acciones iniciales en los receptores y enzimas, a la larga provocan que los genes decisivos sean activados o desactivados. Uno de ellos podría ser de hecho el BDNF, aunque sin duda intervienen muchos otros.
Por tanto, la hipótesis de la expresión génica es coherente con la hipótesis de los receptores monoaminérgicos en la acción antidepresiva, aunque de mayor alcance.
Las acciones retardadas de los antidepresivos no sólo pueden explicar el retraso en el inicio de la acción terapéutica de los antidepresivos, también pueden aclarar por qué algunos pacientes no responden a los antidepresivos, ya que es posible que en dichos pacientes las acciones farmacológicas iniciales no se traduzcan en las acciones farmacológicas y genéticas retardadas necesarias. Conocer las bases biológicas de la falta de respuesta al tratamiento puede conducir a un avance enormemente necesario en la farmacoterapia de la depresión, a saber, un tratamiento eficaz para los pacientes deprimidos que no responden o son refractarios al tratamiento.
Farmacocinética de los antidepresivos
La farmacocinética es el estudio del modo en que el cuerpo actúa sobre los fármacos, especialmente cómo los absorbe, distribuye, metaboliza y excreta. Estas acciones farmacocinéticas son mediadas a través del sistema metabólico hepático e intestinal conocido como sistema enzimático del citocromo P450 (CYP450).
Los enzimas CYP450 y las acciones farmacocinéticas que representan deben confrontar con las acciones farmacodinámicas de los antidepresivos, que ya hemos visto en el anterior apartado sobre los mecanismos de acción de los antidepresivos. Aunque la mayor parte de este libro trata de la farmacodinámica de los agentes psicofarmacológicos, especialmente de cómo dichos fármacos actúan sobre el cerebro, en este apartado abordaremos la farmacocinética de los antidepresivos y estabilizadores del estado de ánimo, es decir, cómo actúa el cuerpo sobre estos fármacos.
Los enzimas CYP450 siguen el principio de transformar sustratos en productos. Específicamente, el enzima CYP450 en la pared intestinal o el hígado convierte el sustrato farmacológico en un producto biotransformado que pasa al torrente sanguíneo. Después de pasar a través de la pared intestinal y del hígado, el fármaco existirá en parte como fármaco no modificado y en parte como producto biotransformado.
Farmacocinética y farmacodinámica
Farmacocinética:
- Cómo actúa el cuerpo sobre los fármacos.
Farmacodinámica:
- Cómo actúan los fármacos en el cuerpo, especialmente en el cerebro.
En esta área de la terapéutica, en rápida evolución, la única manera de estar al día es consultar constantemente los materiales de referencia estándar actualizados sobre las interacciones farmacológicas y las consecuencias concretas que dichas interacciones tienen en la dosificación.
Resumen de farmacocinética
Hay que evitar algunas combinaciones.
Varias combinaciones requieren que se ajusten la dosis de uno o más fármacos.
Muchas interacciones farmacológicas resultan estadísticamente significativas pero clínicamente insignificantes.
Antidepresivos clásicos: inhibidores de la monoaminooxidasa y antidepresivos tricíclicos
Inhibidores de la monoaminooxidasa
Los primeros antidepresivos clínicamente eficaces descubiertos eran inhibidores inmediatos del enzima monoaminooxidasa. Fueron descubiertos accidentalmente cuando se observó que un fármaco antituberculoso mejoraba la depresión que coexistía en algunos pacientes con tuberculosis. Este hallazgo pronto llevó a la síntesis, en las décadas 50 y 60, de más fármacos que inhibían a la MAO pero que carecían de las propiedades adicionales no deseadas (p.e. antituberculosas). Aunque mejor conocidos como potentes antidepresivos, los inhibidores de la MAO (IMAO) son también agentes terapéuticos para algunos trastornos de ansiedad, como el trastorno de pánico y la fobia social.
Los IMAO originales son todos irreversibles del enzima, que se unen a la MAO irreversiblemente y destruyen para siempre su función, de manera que la actividad enzimática sólo puede recuperarse por medio de la síntesis de un nuevo enzima. Algunas veces a estos inhibidores se les denomina “inhibidores suicidas” porque una vez el enzima se une al inhibidor, prácticamente el primero se “suicida” ya que nunca puede volver a funcionar hasta que una nueva proteína enzimática sea sintetizada por el ADN neuronal en el núcleo de la célula.
Existen dos subtipos de MAO, la A y la B. Ambas formas son inhibidas por los IMAO originales, que, por tanto no son selectivos.
MAO-A: Metaboliza los neurotransmisores monoaminérgicos más estrechamente asociados a la depresión, es decir, serotonina y norepinefrina. Por consiguiente, metaboliza también la amina asociada al control de la presión sanguínea (la NE). Por ello, la inhibición de la MAO-A está asociada tanto a las acciones antidepresivas, como a los efectos secundarios hipertensivos no deseables.
MAO-B: Se cree que convierte algunos sustratos aminérgicos, llamados protoxinas, en toxinas que pueden causar daño neuronal. La inhibición de la MAO-B está asociada a la prevención de procesos neurodegenerativos, como la enfermedad de Parkinson.
En los últimos años se han dado avances respecto a los IMAO. Uno es la producción de inhibidores selectivos de la MAO-A o de la MAO-B. El otro es la producción de inhibidores de la MAO-A reversibles. Las implicaciones de estos avances son múltiples.
Una de las propiedades más molestas de los IMAO originales, irreversibles y no selectivos, es el hecho de que, tras haber inhibido la MAO, las aminas ingeridas en la dieta pueden causar un aumento peligroso de la presión sanguínea. Normalmente, estas aminas procedentes de la dieta son metabolizadas de manera segura por la MAO antes de que puedan causar un aumento de la presión sanguínea. Sin embargo, cuando la MAO es inhibida, la presión sanguínea puede aumentar repentina y espectacularmente, pudiendo causar hemorragias intracerebrales y la muerte tras la ingestión de ciertos alimentos o bebidas que contengan tiramina (como el queso). Este riesgo se puede controlar restringiendo la dieta de tal manera que los alimentos peligrosos sean eliminados y reduciendo también el uso simultáneo de ciertas medicaciones peligrosas (p.e. el analgésico meperidina, los inhibidores selectivos de la recaptación de serotonina y los agentes simpaticomiméticos). El riesgo de las crisis hipertensivas y el engorro de restringir la dieta y la medicación han sido generalmente el precio que los pacientes han tenido que pagar para conseguir los beneficios terapéuticos de los IMAO.
En el caso de los inhibidores de la MAO-B, al no inhibirse cantidades significativas de la MAO-A, no hay un riesgo especial de hipertensión por las aminas de la dieta. Los pacientes que toman inhibidores de la MAO- B para impedir la progresión de la enfermedad de Parkinson, p.e., no requieren una dieta especial.
Se está introduciendo una nueva clase de IMAO en la práctica clínica para el tratamiento de la depresión, conocidos como inhibidores reversibles de la MAO-A (IRMA). Es decir, los inhibidores suicidas están asociados a los peligrosos episodios hipertensivos antes mencionados y aparecen cuando los pacientes comen alimentos ricos en tiramina (queso). Esta denominada “reacción al queso” se produce cuando la tiramina de la dieta libera NE y otras aminas simpaticomiméticas. Cuando la MAO es inhibida irreversiblemente, los niveles de estas aminas se elevan hasta un extremo peligroso porque no son destruidas por la MAO. La presión sanguínea se eleva vertiginosamente, causando la ruptura de vasos sanguíneos en el cerebro.
Con los IRMA, si se come queso, la tiramina todavía liberará aminas simpaticomiméticas, pero estas aminas ahuyentarán al inhibidor reversible fuera del enzima MAO, permitiendo que las aminas peligrosa sean destruidas. Los IRMA tienen los mismos efectos terapéuticos que los inhibidores suicidas, sin el peligro de la reacción al queso.
Antidepresivos tricíclicos
Los antidepresivos tricíclicos fueron llamados así porque su estructura química orgánica contiene tres anillos. Fueron sintetizados más o menos al mismo tiempo que otras moléculas de tres anillos que habían demostrado ser eficaces tranquilizantes para la esquizofrenia (clorpromacina), pero resultaron decepcionantes cuando se probaron como antipsicóticos y prácticamente fueron descartados. Sin embargo, durante las pruebas se descubrió que eran antidepresivos y tras un cuidadoso estudio clínico se confirmaron las propiedades antidepresivas en pacientes esquizofrénicos, aunque no se constataron propiedades antipsicóticas.
Mucho tiempo después de que se observaran sus propiedades antidepresivas se descubrió que los tricíclicos bloqueaban las bombas de recaptación tanto de la serotonina como de la norepinefrina, y en menor medida, de la dopamina.
Además, esencialmente todos los antidepresivos tricíclicos tienen al menos otras tres acciones:
el bloqueo de los receptores colinérgicos muscarínicos
el bloqueo de los receptores de la histamina H1
el bloqueo de los receptores adrenérgicos alfa 1
Mientras que el bloqueo de las bombas de recaptación de 5HT y NE da cuenta de las acciones terapéuticas de estos fármacos, se cree que las otras tres propiedades farmacológicas explican los efectos secundarios de los ATC.
Los ATC bloquean también los canales de sodio del corazón y el cerebro, lo que puede causar arritmias cardiacas y parada cardiaca por sobredosis, además de ataques.
En cuanto a las acciones terapéuticas de los ATC, esencialmente trabajan como moduladores alostéricos del proceso de recaptación del neurotransmisor. Concretamente, los ATC son moduladores alostéricos negativos. Cuando los neurotransmisores NE y 5HT se unen a sus propios sitios receptores selectivos, normalmente son transportados de vuelta a la neurona presináptica. Sin embargo, cuando ciertos antidepresivos se unen a un sitio alostérico cercano al transportador del neurotransmisor, éste ya no es capaz de unirse allí, bloqueando la recaptación sináptica del neurotransmisor. Por tanto, la 5HT y la NE no pueden ser enviadas de vuelta a la neurona.
Por lo que respecta a los efectos secundarios de los ATC, el bloqueo de los receptores adrenérgicos alfa 1 origina hipotensión ortostática y mareos. Las acciones anticolinérgicas en los receptores colinérgicos muscarínicos causan sequedad en la boca, visión borrosa, retención urinaria y estreñimiento, así como trastornos de memoria. El bloqueo de los receptores de histamina H1 causa sedación y aumento de peso.
Inhibidores selectivos de la recaptación de serotonina
Qué tienen en común los cinco fármacos
Los ISRS constituyen una clase de fármacos con cinco miembros prominentes, que en conjunto integran la mayoría de las prescripciones de antidepresivos en EEUU y en varios países más. Estos son:
Fluoxetina
Sertralina
Paroxetina
Fluvoxamina
Citalopram
Aunque cada uno de estos cinco ISRS pertenece a una familia químicamente distinta, todos ellos tienen una importante característica en común, a saber, su potente y selectiva inhibición de la recaptación de serotonina, más fuerte que sus acciones en la recaptación de NE o en los receptores alfa 1, de histamina H1 o colinérgicos muscarínicos, y su prácticamente nula capacidad para bloquear los canales de sodio, aún en caso de sobredosis.
Todos los ISRS comparten importantes características que los diferencian de los ATC, a los que han reemplazado en gran medida en la práctica clínica. Es decir, los ISRS tienen propiedades inhibitorias de la recaptación de 5HT más potentes y selectivas que los ATC. Al eliminar las propiedades farmacológicas indeseables de los ATC, los ISRS eliminan también los efectos secundarios indeseables a ellos asociados.
En particular, los ISRS carecen del peligro de sobredosis que comparten todos los ATC (mientras que la administración de un ATC durante 15 días puede representar una dosis letal, los ISRS, en cambio, raramente –por no decir nunca- causan por sí solos la muerte por sobredosis.
Mecanismos de acción farmacológica y molecular de los ISRS
Aunque clásicamente se ha hecho hincapié en la acción de los ISRS en el terminal axónico presináptico, las investigaciones más recientes han determinado que los eventos que ocurren en el extremo somatodendrítico de la neurona serotoninérgica (cerca del cuerpo celular) pueden ser más importantes para explicar sus acciones terapéuticas. Es posible que los eventos que ocurren en la neurona serotoninérgica postsináptica medien los efectos secundarios agudos y el desarrollo de la tolerancia a dichos efectos a la larga.
La hipótesis monoaminérgica de la depresión afirma que en el estado depresivo puede haber una deficiencia de serotonina, tanto en las áreas somatodendríticas presinápticas (cerca del cuerpo celular), como en la propia sinapsis, cerca del terminal axónico. Las tasas de descarga neuronal pueden verse reducidas.
La hipótesis de los receptores de los neurotransmisores sostiene que los receptores pre y postsinápticos se pueden regular al alza.
La hipótesis monoaminérgica de la acción génica retardada sugiere que es posible que estos receptores no sean capaces de transducir la ocupación del receptor por la 5HT en la necesaria regulación de los genes postsinápticos, como los del factor BDNF.
También es posible que la neurona serotoninérgica sea normal pero que los eventos desencadenados por los ISRS contrarresten las deficiencias neuroquímicas en otras partes del cerebro.
Cuando se administra un ISRS de forma aguda, la serotonina aumenta debido al bloqueo de su bomba de transporte. Lo que ha resultado sorprendente, sin embargo, ha sido descubrir que el bloqueo de la bomba de recaptación presináptica no produce inmediatamente una gran acumulación de serotonina en la sinapsis. En realidad, cuando se inicia un tratamiento con ISRS, la 5HT alcanza un nivel mucho más elevado en el área de los cuerpos celulares del rafe mesencefálico que en las áreas cerebrales donde terminan los axones. El área somatodendrítica de la neurona serotoninérgica es donde se incrementa primero la serotonina, y los receptores serotoninérgicos presentan una farmacología 5HT1A. A la larga, el incremento de 5HT en los autorreceptores somatodendríticos 5HT1A tiene el efecto de regularlos a la baja y de desensibilizarlos. La reacción del genoma a esta información consiste en dar instrucciones que hacen que esos mismos receptores se desensibilicen con el tiempo. El curso temporal de esta desensibilización se corresponde con el inicio de las acciones terapéuticas de los ISRS.
Una vez que los autorreceptores somatodendríticos 5HT1A se desensibilizan, la 5HT ya no puede inhibir eficazmente su propia liberación, y, en consecuencia, la neurona serotoninérgica queda desinhibida. Esto da como resultado una avalancha de liberación de 5HT desde los axones debido a un incremento en el flujo de los impulsos neuronales. Esta es otra manera de decir que la liberación de serotonina se “pone en marcha” en los terminales axónicos. La serotonina que ahora fluye de las diversas proyecciones de las vías serotoninérgicas del cerebro teóricamente media las distintas acciones terapéuticas de los ISRS.
Mientras los autorreceptores somatodendríticos presinápticos se desensibilizan, la serotonina se acumula en la sinapsis, haciendo que se desensibilicen también los receptores serotoninérgicos postsinápticos.
Dichos receptores, a su vez, envían esta información al núcleo celular de la neurona postsináptica a la que se dirige la serotonina. La reacción del genoma de la neurona postsináptica es también dar instrucciones para regular a la baja o desensibilizar dichos receptores. El curso temporal de esta desensibilización se corresponde con el inicio de la tolerancia a los efectos secundarios de los ISRS.
Esta teoría sugiere un mecanismo farmacológico en cascada por el cual los ISRS ejercen sus acciones terapéuticas, a saber, una potente desinhibición de la liberación de 5HT en las vías clave de todo el cerebro. Por otra parte, los efectos secundarios se deben hipotéticamente, a las acciones agudas de la serotonina en receptores no deseables situados en vías no deseables. Finalmente, los efectos secundarios pueden atenuarse a la larga debido a la desensibilización de los propios receptores que median dichos efectos.
Vías y receptores serotoninérgicos que median las acciones terapéuticas y los efectos secundarios de los ISRS
Los ISRS causan tanto sus acciones terapéuticas como sus efectos secundarios aumentando la serotonina en las sinapsis, donde se bloquea la recaptación y se desinhibe la liberación de serotonina.
Comprendiendo las funciones de las diversas vías serotoninérgicas y la distribución de los distintos subtipos de receptores serotoninérgicos, es posible entender mejor tanto las acciones terapéuticas como los efectos secundarios.
En cuanto a las acciones antidepresivas, la evidencia apunta a la proyección de neuronas serotoninérgicas desde el rafe mesencefálico a la corteza frontal como el sustrato de su acción terapéutica.
Las acciones terapéuticas en la bulimia, la voracidad y varios trastornos más de los hábitos alimentarios pueden estar mediadas por la vía serotoninérgica desde el rafe a los centros de la alimentación y el apetito en el hipotálamo.
Dado que diversas vías parecen mediar las distintas acciones terapéuticas de los ISRS, no resultaría sorprendente que los papeles terapéuticos de la serotonina difieran de una indicación terapéutica a otra.
De hecho, éste parece ser el caso, y ello podría constituir la base de los diferentes perfiles terapéuticos de los ISRS de unas indicaciones a otras.
Las distintas acciones antidepresiva y antibulímica, p.e., vienen indicadas por diferentes dosis, diferentes momentos de inicio de la acción y distinta documentación sobre las acciones a largo plazo.
Perfil antidepresivo de los ISRS
La dosis inicial suele ser la misma que la de mantenimiento.
El inicio de la respuesta suele producirse entre 3 y 8 semanas después.
La respuesta es frecuentemente la remisión completa de los síntomas.
Los síntomas específicos no empeoran una vez iniciado el tratamiento.
Perfil antibulímico de los ISRS
La dosis inicial suele ser mayor que en otras indicaciones.
El inicio de la respuesta puede ser más rápido que en otras indicaciones.
Puede que no sea tan efectivo como en otras indicaciones para mantener crónicamente los efectos agudos.
La Fluoxetina tiene los mejores datos de eficacia hasta la fecha y también propiedades 5HT2C.
Los síntomas específicos no empeoran al inicio del tratamiento.
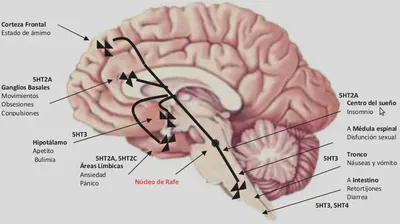
En lo que se refiere a los efectos secundarios de los ISRS, la estimulación aguda de al menos cuatro subtipos de receptores serotoninérgicos pueden ser la responsable de mediar estas acciones no deseables.
Se trata de los siguientes receptores:
5HT2A y 5HT2C (en la proyección desde el rafe a la corteza límbica): puede causar agitación mental aguda, ansiedad o inducción de ataques de pánico.
5HT2A (ganglios basales): puede ocasionar cambios en los movimientos motores, como acatisia (intranquilidad), retraso psicomotor, incluso leves movimientos parkinsonianos y distónicos, debidos a la inhibición serotoninérgica de la neurotransmisión de dopamina en los ganglios.
5HT2A (centros del sueño del tronco cerebral): puede provocar movimientos musculares rápidos (mioclonos) durante la noche, perturbar el sueño de ondas lentas y despertares nocturnos.
5HT2A (médula espinal): puede inhibir los reflejos espinales del orgasmo y la eyaculación y causar disfunción sexual.
5HT2A (centros de placer mesocorticales): puede reducir la actividad dopaminérgica y provocar apatía (recuperaciones apáticas) o disminución de la líbido.
5HT3 (hipotálamo o tronco cerebral): puede causar náuseas o vómitos respectivamente.
5HT3 y 5HT4 (tracto intestinal): incremento de la motilidad intestinal, calambres gastrointestinales y diarrea.
Si los receptores postsinápticos que teóricamente median los efectos secundarios se regulan a la baja o se desensibilizan, los efectos secundarios se atenúan o desaparecen. Afortunadamente, los efectos secundarios de los ISRS constituyen más una molestia que un peligro, y en general se atenúan con el tiempo, aunque pueden hacer que un importante subgrupo de pacientes interrumpa su administración prematuramente.
Inhibidores “no tan selectivos” de la recaptación de serotonina: ¿cinco únicos fármacos, o una clase con cinco miembros?
Nota del equipo docente: No se precisan los contenidos de este aptdo., aunque es conveniente conocer la explicación relativa a los ISRS con selectividad parcial.
Inhibidores selectivos de la recaptación noradrenérgica
Aunque algunos ATC bloquean la recaptación de NE más potentemente que la recaptación de serotonina, ni tan siquiera estos ATC son realmente selectivos, puesto que siguen bloqueando los receptores alfa 1, de histamina H1 y colinérgicos muscarínicos, como hacen los ATC.
El primer inhibidor de la recaptación noradrenérgica (IRN) realmente selectivo es la reboxetina, que carece de estas propiedades indeseables.
La reboxetina constituye el lógico complemento farmacológico de los ISRS, puesto que proporciona una inhibición noradrenérgica selectiva mayor que la inhibición de la recaptación de la serotonina, pero sin las propiedades indeseables de los ATC.
Aunque la NE y la 5HT tienen funciones coincidentes en la regulación del estado del ánimo, el hipotético síndrome de deficiencia noradrenérgica no es idéntico al hipotético síndrome de deficiencia serotoninérgica. Por otra parte, no todos los pacientes con depresión responden a un ISRS ni todos responden a un IRN selectivo, aunque puede que haya más que respondan a los agentes, o combinaciones de agentes, que bloquean tanto la recaptación serotoninérgica como la noradrenérgica.
Además, muchos pacientes que responden a los bloqueadores de la recaptación de serotonina no experimentan una remisión completa, y parece que su estado de ánimo haya mejorado pero que presenta un permanente síndrome de deficiencia noradrenérgica, lo que a veces se denomina respuesta apática a los ISRS.
Aunque todavía no es posible determinar quién responderá a un agente serotoninérgico y quién lo hará a un agente noradrenérgico antes de iniciar un tratamiento empírico, existe la idea de que quienes presentan el síndrome de deficiencia serotoninérgica (depresión asociada a ansiedad, pánico, fobias, trastorno de estrés postraumático, obsesiones, compulsiones y trastornos de la alimentación) podrían responder mejor a los antidepresivos serotoninérgicos.
Esta idea se ve respaldada por el hecho de que los antidepresivos serotoninérgicos resultan eficaces no sólo en la depresión, sino también en el trastorno obsesivo-compulsivo, trastornos de la alimentación, el pánico, la fobia social e, incluso el trastorno de estrés postraumático.
Por otra parte, los pacientes con el síndrome de deficiencia noradrenérgica (depresión asociada a la fatiga, apatía y trastornos cognitivos notables, especialmente un deterioro de la concentración, problemas a la hora de centrar y mantener la atención, lentitud en el procesamiento de la información y deficiencias en la memoria de trabajo) teóricamente podrían responder mejor a los agentes noradrenérgicos.
Dado que hace muy poco que se dispone de los inhibidores selectivos de la recaptación noradrenérgica, esta teoría se basa en la investigación con animales.
Las primeras indicaciones relativas al uso de la reboxetina muestran que su eficacia resulta cuando menos comparable a la de los ATC y los ISRS. Además, la reboxetina puede potenciar específicamente el funcionamiento social, quizá convirtiendo la repuesta apática en una remisión completa.
Por otra parte, la reboxetina puede resultar útil para la depresión grave, para la depresión que no responda a otros antidepresivos y como complemento de los antidepresivos serotoninérgicos cuando se necesitan mecanismos neurotransmisores duales para tratar los casos más difíciles.
Varias vías y receptores noradrenérgicos concretos median tanto las acciones terapéuticas como los efectos secundarios de los IRN selectivos.
En lo que se refiere a su acción antidepresiva, las evidencias apuntan a la proyección de las neuronas noradrenérgicas desde el locus coeruleus a la corteza frontal como el sustrato de esta acción terapéutica.
El subtipo del receptor noradrenérgico que puede mediar las acciones antidepresivas de la norepinefrina en este caso es el receptor postsináptico beta 1. Las acciones terapéuticas en la cognición no se han establecido todavía, pero teóricamente podrían estar mediadas por la vía noradrenérgica desde el locus coeruleus a otras áreas de la corteza cerebral. Teóricamente las acciones terapéuticas en la mejora de la apatía, la fatiga y el retraso psicomotor podrían estar mediadas por la vía noradrenérgica desde el locus coeruleus a la corteza límbica.
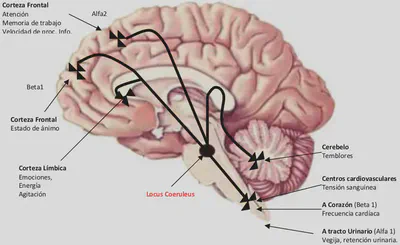
En cuanto a los efectos secundarios de los IRN selectivos, la estimulación de al menos cuatro subtipos de receptores noradrenérgicos clínicamente importantes en varias partes del cerebro y del cuerpo puede ser la responsable de mediar en dichas acciones indeseables. Esto incluye:
Los receptores postsinápticos alfa 1.
Los receptores presinápticos alfa 2.
Los receptores postsinápticos alfa 2.
Los receptores postsinápticos beta 1: en el cerebelo o en el SNS periférico puede provocar activación motora o temblor. En el sistema límbico, agitación. En los centros cardiovasculares del tronco cerebral y en los que descienden por la médula espinal, alteraciones de la presión sanguínea. En el corazón puede provocar cambios en la frecuencia cardiaca
La estimulación de los receptores noradrenérgicos en el SNS puede causar una reducción neta del tono colinérgico parasimpático con sequedad en la boca, estreñimiento y retención urinaria.
Prácticamente todos los efectos secundarios de los IRN selectivos se pueden concebir como acciones indeseables de la NE, en vías indeseables de subtipos de receptores indeseables. Afortunadamente, estos efectos secundarios constituyen, al igual que los de los ISRS, más una molestia que un peligro, y en general, se atenúan con el tiempo, aunque pueden hacer que en un importante subgrupo de pacientes se interrumpa el tratamiento.
Bloqueadores de la recaptación de norepinefrina y de dopamina
El bupropión es el agente prototípico del grupo de inhibidores de la recaptación de norepinefrina y de dopamina (IRND). Durante muchos años, su mecanismo de acción no estuvo claro, ya que el bupropión en sí tiene débiles propiedades de recaptación de la dopamina y más débiles todavía para la norepinefrina.
La acción de este fármaco, sin embargo, siempre ha parecido ser más potente de lo que estas débiles propiedades podían explicar, lo que ha llevado a pensar que el bupropión actuaba de manera bastante vaga como un modulador adrenérgico de algún tipo.
El bupropión es metabolizado a un metabolito activo, que no sólo es un bloqueador de la recaptación de norepinefrina más potente que el mismo bupropión, sino que, además se concentra en el cerebro. En algunos aspectos, el bupropión es más un profármaco (un precursor), más que un fármaco en sí mismo.
En general, el bupropión es un activador, o incluso, un estimulante. Curiosamente, el bupropión SR no parece estar asociado a la producción de la molesta disfunción sexual que se puede dar con los ISRS, debido probablemente a que el bupropión carece de un componente serotoninérgico significativo para su mecanismo de acción. Puede ser un antidepresivo útil no sólo para los pacientes que no pueden tolerar los efectos secundarios de los ISRS, sino también para los pacientes cuya depresión no responde a la estimulación serotoninérgica de los ISRS. El bupropión SR resulta también útil para reducir el ansia asociada a dejar de fumar.
Una preocupación potencial que hace que quienes financian investigaciones farmacéuticas no prueben los inhibidores de la recaptación de dopamina como antidepresivos es la posibilidad de que tengan un efecto de refuerzo que lleve a un abuso en su consumo similar al abuso de estimulantes.
Inhibidores duales de la recaptación de serotonina y norepinefrina
Una clase de antidepresivos que combina las acciones tanto de los inhibidores selectivos de la recaptación de serotonina (ISRS) como de los inhibidores selectivos de la recaptación noradrenérgica (IRN) es la denominada clase de los inhibidores duales de la recaptación de 5HT y NE (IRSN). Esta denominación puede ser confusa, ya que muchos ATC son también inhibidores duales de la recaptación de NE y 5HT. Lo que constituye la característica única de la venlafaxina, el IRSN prototípico, es que comparte las propiedades inhibidoras de la recaptación de NE y 5HT -y en menor medida, dopamina (DA)- con los ATC clásicos, pero sin las propiedades bloqueadoras de los receptores alfa 1, de los receptores colinérgicos o de los receptores de histamina. Los IRSN son agentes de acción dual y también selectivos para dicha acción.
La venlafaxina es el único IRSN de acción dual que se comercializa actualmente. En función de la dosis, tiene distintos grados de recaptación:
5HT: Más potente y, por tanto, presente a dosis bajas.
NE: De potencia moderada, y por tanto, presente a dosis altas.
DA: Menos potente y, por tanto, presente sólo a dosis más altas.
No hay acciones significativas en otros receptores.
Actualmente la venlafaxina está disponible en una formulación de liberación prolongada (venlafaxina XR), lo cual no sólo permite su administración una vez al día, sino que también reduce significativamente los efectos secundarios, en especial las náuseas. El incremento de la tolerabilidad de esta formulación es importante si se tiene en cuenta la tendencia en psiquiatría a utilizar dosis más altas para explotar tanto el mecanismo de inhibición de la NE como el de 5HT.
Los antidepresivos originarios tenían múltiples efectos farmacológicos, y se les calificaba de “fármacos sucios” debido a que muchos de dichos mecanismos eran indeseables, puesto que causaban efectos secundarios. La idea era “limpiar” dichos agentes haciéndolos selectivos, y así nació la era de los ISRS. De hacho al hacer a dichos agentes selectivos se les despojó de las propiedades farmacológicas que mediaban los efectos secundarios anticolinérgicos, antihistamínicos y antiadrenérgicos. Sin embargo, en ocasiones la selectividad puede resultar menos deseable que unos mecanismos farmacológicos múltiples, como en los casos difíciles que son resistentes al tratamiento con fármacos que tienen un mecanismo serotoninérgico selectivo.
Esto ha llevado al desarrollo de fármacos que exhiben una “polifarmacia intramolecular”, como los IRSN duales. Asimismo, ha llevado al creciente uso de dos antidepresivos juntos para los casos resistentes al tratamiento, combinando dos o más mecanismos terapéuticos sinérgicos.
La sinergia es la acción conjunta de dos o más mecanismos de modo que su eficacia total es mayor que la suma de sus partes (o, en otras palabras 1+1=10).
Los indicios de que puede haber una sinergia antidepresiva derivada de las acciones duales 5HT y NE que se corresponda con eventos moleculares teóricos provienen de diversos estudios según los cuales, en los trastornos de depresión mayor, la venlafaxina ha producido unos índices de remisión superiores a los de los ISRS. Otros indicios son:
Parece tener una mayor eficacia a medida que aumenta la dosis, mientras que otros antidepresivos apenas parece haber diferencia en sus dosis más elevadas. La eficacia aumenta más cuando se activa el segundo mecanismo y refuerza la lógica de utilizar mecanismos duales en los pacientes difíciles.
La venlafxina es un ansiolítico generalizado eficaz y es el único antidepresivo aprobado para el tratamiento de la ansiedad generalizada. Tales acciones podrían tener las favorables consecuencias terapéuticas de convertir la depresión ansiosa en una remisión completa tanto de la depresión como de la ansiedad.
Otra evidencia proviene de que los ATC de acción dual pero no selectivos, parecen ser eficaces también como ansiolíticos generalizados, aunque nunca se han comercializado para esta indicación.
Acciones duales serotoninérgicas y noradrenérgicas a través del antagonismo Alfa 2
El bloqueo de la bomba de recaptación monoaminérgica o del enzima monoaminooxidasa (MAO) no es el único mecanismo para incrementar la serotonina y la norepinefrina. Otra manera de elevar los niveles tanto de una como de otra es bloquear los receptores alfa 2. Recuérdese que la NE interrumpe su propia liberación interactuando con los autorreceptores alfa 2 presinápticos en las neuronas noradrenérgicas.
Asimismo, la NE interrumpe la liberación de serotonina interactuando con los heterorreceptores alfa 2 presinápticos en las neuronas serotoninérgicas.
Si se administra un antagonista alfa 2, la NE ya no puede interrumpir su propia liberación, y en consecuencia, las neuronas noradrenérgicas son desinhibidas. Es decir, el antagonista alfa 2 “corta el cable de freno” de la neurona noradrenérgica, y por tanto, se incrementa la liberación de NE.
Del mismo modo, los antagonistas alfa 2 no permiten que la NE interrumpa la liberación de 5HT. En consecuencia, las neuronas serotoninérgicas resultan desinhibidas. De forma parecida a sus acciones en las neuronas noradrenérgicas, los antagonistas alfa 2 actúan en las neuronas serotoninérgicas “cortando el cable de freno” de la inhibición noradrenérgica de la serotonina, por tanto, se incrementa la liberación de serotonina.
Un segundo mecanismo para incrementar la liberación de 5HT tras la administración de un antagonista alfa 2 puede ser aún más importante. Recuérdese que la neuronas noradrenérgicas del locus coeruleus inervan los cuerpos celulares de las neuronas serotoninérgicas del rafe mesencefálico. Este estímulo noradrenérgico aumenta la liberación de serotonina a través del receptor alfa 1 postsináptico. Así, cuando la NE resulta desinhibida en la vía noradrenérgica hacia el rafe, la liberación de NE se incrementará y estimulará los receptores alfa 1, provocando así la liberación de más 5HT. Esto equivale a “pisar el acelerador” de la serotonina. Por lo tanto, los antagonistas alfa 2 “cortan el cable de freno” a la vez que “pisan el acelerador” de la liberación de 5HT.
Las acciones de los antagonistas alfa 2 producen un aumento dual de la liberación tanto de serotonina como de norepinefrina. Aunque no hay ningún antagonista alfa 2 disponible para su uso como antidepresivo, sí se dispone en todo el mundo de un fármaco antidepresivo con destacadas propiedades alfa 2, la mirtazapina. La mirtazapina no bloquea ningún transportador monoaminérgico, pero además de sus potentes acciones antagonistas en los receptores alfa 2 tiene también acciones agonistas en los receptores de 5HT2A, 5HT2C y 5HT3, y en los receptores de histamina H1.
Las acciones de la mirtazapina en las sinapsis serotoninérgicas (5HT). Cuando se bloquean los heterorreceptores alfa 2 presinápticos se libera 5HT, pero ésta se dirige al receptor 5HT1A debido a que las acciones de 5HT en los receptores 5HT2A, 5HT2C y 5HT3 están bloqueadas. El resultado de ello es que las acciones antidepresivas y ansiolíticas quedan preservadas, pero los efectos secundarios asociados a la estimulación de los receptores 5HT2A, 5HT2C y 5HT3 quedan bloqueados. Sin embargo, estas acciones pueden dar como resultado sedación y ganancia de peso (pie fig. 7.11).
Cuando la mirtazapina bloquea los receptores histamina H1 puede provocar acciones ansiolíticas, pero también sedación y ganancia de peso como efectos secundarios.
Además de su eficacia como antidepresivo de primera línea, la mirtazapina puede ver incrementada su eficacia debido a su mecanismo de acción dual, especialmente en combinación con otros antidepresivos que bloquean la recaptación de 5HT y/o NE. La mirtazapina puede ser útil también en el trastorno de pánico, en el trastorno de ansiedad generalizada y en otros trastornos de ansiedad, pero no se ha investigado detenidamente para estas indicaciones.
Fármacos de acción dual: antagonistas de la serotonina-2 e inhibidores de la recaptación de serotonina
Hay otra clase química de antidepresivos conocidos como fenilpiperacinas, que son más selectivos que los ATC y cuya acción farmacológica más potente es la de bloquear los receptores de serotonina 2a. Esta clase incluye a los agentes nefazodona y trazodona. Ambos bloquean también la recaptación de serotonina, aunque de una manera menos potente que los antidepresivos tricíclicos o que los ISRS. Dado que el mecanismo farmacológico de acción de estos agentes de acción dual, antagonistas de la serotonina 2a e inhibidores de la recaptación de la serotonina, se deriva de una combinación de un potente antagonismo de los receptores de serotonina 2a junto con un bloqueo, menos potente, de la recaptación de serotonina, se les clasifica separadamente como “antagonistas de la serotonina 2 A/inhibidores de las recaptación” (ASIR).
La nefazodona es el miembro prototípico del grupo ASIR de antidepresivos. Es un potente antagonista 5HT2A, con acciones secundarias como inhibidor de la recaptación de 5HT y NE. También bloquea los receptores alfa 1, pero las consecuencias clínicas de ello generalmente no son importantes, debido quizás a que su inhibición de la recaptación de norepinefrina reduce esta acción “in vivo”.
La combinación del agonismo 5HT1A indirecto con el antagonismo 5HT2A directo constituye otro ejemplo de “polifarmacia intramolecular” que explota la sinergia existente entre estos dos mecanismos y sugiere, de nuevo, que a veces dos mecanismos antidepresivos pueden ser mejor que uno.
P.e.: Ya hemos visto que la estimulación de los receptores 5HT1A en el rafe puede ser beneficiosa para la depresión, pero también que la estimulación de los receptores 5HT2A y 5HT2C en la corteza límbica puede causar agitación o ansiedad, y que la estimulación de los receptores 5HT2A en la médula espinal puede acarrear disfunciones sexuales. Así pues, un agente que combine el bloqueo de la recaptación de 5HT con un antagonismo 5HT2A más fuerte teóricamente reduciría las acciones no deseadas de la estimulación de los receptores 5HT2A por la 5HT. En este caso, la competencia entre el bloqueo de la recaptación de serotonina y el antagonismo 5HT2A, más fuerte, tiene como resultado un antagonismo neto en los receptores 5HT2A. De hecho, el ASIR nefazodona carece teóricamente del potencial de causar disfunciones sexuales, así como los usuales insomnio y ansiedad, asociados a los ISRS.
La trazodona fue el primer miembro del grupo ASIR de antidepresivos. También bloquea los receptores alfa 1 y los receptores de histamina. Quizá debido a sus propiedades bloqueadoras de los receptores de histamina, la trazodona es extremadamente sedante. Por ello, su uso como antidepresivo tiende a ser limitado; no obstante, está bien establecido como un excelente hipnótico que no origina dependencia, aunque en realidad nunca se ha comercializado para esta indicación. Sus dosis sedantes son generalmente inferiores a sus dosis antidepresivas eficaces. La trazodona se utiliza principalmente como complemento de los antidepresivos debido a que no sólo aumenta la tolerabilidad de los ISRS al bloquear sus efectos secundarios asociados a la estimulación de los receptores 5HT2A, como el insomnio y la agitación, sino que también puede potenciar la eficacia terapéutica de los ISRS, quizás explotando la sinergia de bloquear los receptores 5HT2A al tiempo que estimulan los receptores 5HT1A, como ya hemos visto.
Un efecto secundario molesto, aunque poco frecuente, de la trazodona es el priapismo (erecciones prolongadas en los hombres, habitualmente dolorosas), que se puede tratar inyectando en el pene agonistas adrenérgicos alfa para revertir dicho efecto secundario e impedir el daño vascular en el pene.
Nuevos antidepresivos en fase de desarrollo
En la actualidad, lo que se necesita es un antidepresivo que inicie su acción antes de la 2-8 semanas y que resulte eficaz en más de dos de cada tres pacientes. Tal eficacia debería ser sólida, causando la remisión, no sólo la respuesta, y manteniendo dicha remisión durante períodos más largos de tiempo y en una mayor proporción de pacientes que los antidepresivos actuales.
Moduladores monoaminérgicos
Agonistas beta. Los receptores adrenérgicos beta pueden ser rápidamente regulados a la baja mediante agonistas, y si esto es lo que se desea para lograr una acción antidepresiva, los agonistas beta pueden resultar útiles. Hasta la fecha no ha sido posible identificar agonistas beta 1 y beta 2 que penetren bien en el cerebro pero que no sean cardiotóxicos.
Sistemas de segundo mensajero. Teóricamente puede lograrse potenciar la función adrenérgica en un lugar distal al de la ocupación del receptor, tomando como diana bien las proteínas G, bien el enzima adenil ciclasa. Ambos agentes se encuentran en fase de desarrollo. Casualmente podría resultar que algunos de los anticonvulsivos de los que se sabe, o se sospecha, que resultan útiles en el trastorno bipolar, incluyendo la depresión, actúen sobre los sistemas de segundo mensajero.
Agonistas, agonistas parciales y antagonistas de 5HT1A. Aunque se han probado extensamente muchos agonistas 5HT1A en ensayos clínicos, ninguno de ellos se ha comercializado como antidepresivo, y sólo uno se ha aprobado como ansiolítico generalizado. Teóricamente, un antagonista 5HT1A podría ser un antidepresivo de inicio rápido debido a la inmediata desinhibición de la neurona serotoninérgica. Esto se ha demostrado preclínicamente, pero ningún antagonista 5HT1A ha superado las pruebas clínicas de la depresión.
Inhibición de la recaptación de serotonina y dopamina. Los bloqueadores duales de la recaptación de 5HT y DA se hallan en fase de ensayo clínico. Aunque el ISRS Sertralina presenta cierta inhibición de la recaptación de DA además de la inhibición, más potente, de la recaptación de 5HT, la minaprina y la bazinaprina tienen acciones dopaminérgicas más potentes y, en consecuencia, son agentes duales serotoninérgicos/dopaminérgicos.
Antagonistas 5HT1D. Teóricamente, un antagonista 5HT1D debería desinhibir rápidamente la neurona serotoninérgica y, por tanto, ser un antidepresivo de inicio rápido. Están en fase de desarrollo clínico.
Antagonistas neuroquininérgicos
Las consideraciones teóricas y algunas afortunadas observaciones clínicas sugieren que los antagonistas neuroquininérgicos, especialmente los antagonistas NQ1 (es decir, los antagonistas de la sustancia P), pueden ser los nuevos antidepresivos. Están en fase de ensayo clínico.
Nuevos mecanismos neurotransmisores
Otros potencialmente nuevos antidepresivos en fase de ensayo clínico se dirigen a sistemas de neurotransmisores distintos, incluyendo los receptores sigma, péptidos como la neurotensina o la colecistoquinina, y sistemas endógenos de refuerzo como la anandamida. Todos ellos se hallan en una fase de ensayo muy temprana.
Plantas medicinales
Diversas sustancias medicinales como el hipericón, el ingrediente activo de la planta del mismo nombre (llamada también hipérico, hierba de San Juan), se están utilizando ampliamente en todo el mundo, aunque nunca han demostrado sus cualidades antidepresivas bajo un examen tan detallado como los fármacos comercializados como antidepresivos. Sin embargo, se están realizando diversos ensayos clínicos válidos de alto nivel para ver si determinadas plantas medicinales, especialmente el hipericón, demuestran ser tan antidepresivas cuando se las somete al mismo examen por el que debe pasar cualquier fármaco antes de ser comercializado.
Varios informes recientes en relación a la posibilidad de que el hipericón tenga algunos efectos tóxicos en la función reproductora pueden mitigar el entusiasmo por este enfoque. Hay un estudio que sugiere que afecta negativamente a la fertilidad tanto en hombres como en mujeres. Además, existen ciertas evidencias de mutación genética en las células del esperma, lo que posiblemente incremente los riesgos para el feto en desarrollo. Por lo tanto, actualmente no se recomienda tomar esta planta durante el embarazo. (Ni en edad fértil, espero).
Fármacos estabilizadores del estado de ánimo
Litio, el estabilizador del estado de ánimo clásico
Los trastornos del estado de ánimo caracterizados tanto por subidas del estado de ánimo por encima de lo normal como por depresiones por debajo de lo normal son clásicamente tratados con litio, un ión cuyo mecanismo de acción es incierto. Los candidatos para dicho mecanismo de acción son lugares situados más allá del receptor del segundo mensajero, bien como inhibidor de un enzima como modulador de las proteínas G, o incluso como regulador de la expresión génica a través de la modulación de la proteína quinasa C.
El litio no sólo trata episodios agudos de manía e hipomanía, sino que fue el primer agente psicotrópico en el que se demostró la capacidad de prevenir episodios recurrentes de la enfermedad. El litio también puede ser eficaz en el tratamiento y prevención de episodios de depresión en pacientes con trastorno bipolar. Menos efectivo resulta en los ciclos rápidos o en los episodios mixtos. En general, el litio es efectivo en el 40-50% de los pacientes.
Por otra parte, muchos pacientes no pueden tolerarlo debido a sus numerosos efectos secundarios, que requieren control de sus niveles en plasma, incluyendo:
Síntomas gastrointestinales (dispepsia, náuseas, vómitos y diarreas)
Ganancia de peso
Pérdida de cabello
Acné
Temblores
Sedación
Disminución de la cognición
Incoordinación
A largo plazo, efectos sobre la tiroides y los riñones.
Los fármacos anticonvulsivos como estabilizadores del estado de ánimo
Basándose en las teorías que defienden que la manía puede suscitar episodios ulteriores de manía, se percibió un paralelismo lógico con los trastornos convulsivos, dado que las convulsiones pueden suscitar nuevas convulsiones. En consecuencia, se llevaron a cabo ensayos con varios agentes anticonvulsivos, empezando por la carbamapecina, y varios de ellos han mostrado indicios de eficacia en el tratamiento de la base maníaca del trastorno bilpolar. Sin embargo sólo el ácido valproico está aprobado para esta indicación.
El mecanismo de acción de la carbamapecina y del ácido valproico sigue estando poco claro, tanto en sus efectos anticonvulsivos como en lo relativo a sus efectos antimaníacos y estabilizadores del estado de ánimo. Incluso es posible que tengan múltiples mecanismos de acción:
En la membrana celular, los agentes anticonvulsivos parecen actuar interfiriendo e inactivando los canales iónicos, tanto de sodio, como de potasio y calcio.
Cuando se inactivan los canales iónicos se pueden producir cambios en la neurotransmisión tanto excitadora (glutamato) como en la inhibidora (ácido gamma-aminobutírico GABA). En particular, los anticonvulsivos parecen modular los efectos del GABA aumentando su síntesis, aumentando su liberación, inhibiendo su descomposición, reduciendo su recaptación en las neuronas gabérgicas o aumentando sus efectos en los receptores GABA.
Los anticovulsivantes pueden interferir también en la neurotransmisión debida al neurotransmisor excitador glutamato, especialmente reduciendo su liberación.
Ácido valproico: Aunque su mecanismo de acción exacto sigue siendo incierto, el ácido valproico puede inhibir la función de los canales de sodio y/o de calcio, y quizás de este modo, estimular la acción inhibidora del GABA además de reducir la acción excitadora del glutamato. Se utiliza como tratamiento de primera línea para los trastornos bipolares, y también, en combinación con el litio, en los pacientes refractarios a la monoterapia con litio y, especialmente, en los pacientes con ciclos rápidos o mixtos.
Puede tener efectos secundarios inaceptables como pérdida del cabello, ganancia de peso y sedación, trastornos menstruales, ovarios poliquísticos, hiperandrogenismo, resistencia a la insulina y en caso de embarazo, defectos en el tubo neural del feto en desarrollo.
Carmabacepina: fue el primer agente anticonvulsivo que mostró ser efectivo en la fase maníaca del trastorno bipolar. Es posible que su mecanismo de acción consista en estimular en estimular la acción GABA. Sus efectos secundarios pueden incluir sedación y anormalidades hematológicas. No está bien aceptado para su uso como tratamiento de primera línea.
Lamotrigina: está aprobada como anticnvulsivante pero no como estabilizador del estado de ánimo. Inhibe los canales de sodio e inhibe la liberación de glutamato. Numerosos informes sugieren que la lamotrigina no sólo puede estabilizar los episodios maníacos bipolares y mixtos sino que también puede resultar útil para los episodios depresivos de ese trastorno.
Gabapentina: fue sintetizado como análogo del GABA, pero resultó que no modula directamente al receptor GABA. Es posible que interactúe con el transportador GABA e incremente los niveles de esta sustancia. Está aprobado como fármaco anticonvulsivo y, originariamente se observó que mejoraba el estado de ánimo y la calidad de vida de estos pacientes. Numerosos estudios sugieren que resulta eficaz en la fase maníaca del trastorno bipolar.
Topiramato: anticonvulsivante en fase de ensayo clínico como estabilizador del estado de ánimo. Su mecanismo de acción parece consistir en potenciar la función GABA y en reducir la función glutamato. Las acciones estabilizadoras del estado de ánimo se pueden dar a dosis más bajas que sus acciones anticonvulsivas. Este compuesto tiene también el interesante efecto secundario de pérdida de peso en algunos pacientes, un efecto casi único entre los estabilizadadores del estado de ánimo, que generalmente provocan ganancia de peso.
Otros estabilizadores del estado de ánimo
Benzodiacepinas: Tienen acciones anticonvulsivas y sedantes, especialmente el diazepam y el clonazepam oral. Ambas acciones han llevado al uso de las benzodiacepinas para el tratamiento de los trastornos afectivos, especialmente como tratamiento complementario para la agitación y la conducta psicótica durante la fase de manía aguda. Las benzodiacepinas se utilizan también ampliamente en los trastornos de ansiedad y del sueño.
Antipsicóticos: Durante mucho tiempo los neurolépticos clásicos (helperidol y la fenotiacina clorpromacina) han desempeñado un papel en el tratamiento de la agitación y psicosis maníacas. Más recientemente, los antipsicóticos atípicos han empezado a reemplazar a los antiguos neurolépticos y a asumir un importante papel complementario en el tratamiento de los trastornos bipolares y mejorar el estado de ánimo en la esquizofrenia. Actualmente, los antipsicóticos atípicos están siendo más ampliamente utilizados para tratar la fase maníaca del trastorno bipolar.
Combinaciones de fármacos para los pacientes resistentes al tratamiento: polifarmacia racional
La estrategia más frecuente para tratar a los pacientes que no responden a varias monoterapias antidepresivas distintas (refractarios o resistentes al tratamientos), consiste en ampliar el tratamiento con un segundo agente.
Los tres agentes potenciadores más estudiados son el litio, la hormona tiroidea y la buspirona. Otras estrategias de potenciación se emplean comúnmente en la práctica, pero su uso se suele basar más en datos anecdóticos y en la experiencia que en estudios científicos.
El litio y los estabilizadores del estado de ánimo como agentes potenciadores
El litio puede potenciar las acciones antidepresivas de los antidepresivos de primera línea actuando sinérgicamente sobre los sistemas de segundo mensajero.
El litio y los fármacos anticonvulsivos se utilizan también, en combinación con antidepresivos, para la depresión bipolar, sin embargo en este trastorno los estabilizadores del estado de ánimo, constituyen el tratamiento de primera línea, y los antidepresivos se administran únicamente para incrementar una respuesta insuficiente a un estabilizador del estado de ánimo y no al revés.
La hormona tiroidea como agente potenciador
Dado que la enfermedad tiroidea suele estar asociada a la depresión, especialmente en las mujeres, desde hace tiempo se ha observado que tratar las anormalidades del tiroides también puede prevenir la depresión. Incluso se ha observado que administrar hormona tiroidea suplementaria a los pacientes deprimidos que no responden a los antidepresivos de primera línea, aun cuando no presenten un hipotiroidismo manifiesto, puede potenciar la respuesta antidepresiva a los antidepresivos de primera línea.
La buspirona, el agente potenciador de la serotonina 1 A
Si en la depresión la serotonina es baja o está parcialmente agotada en las neuronas serotoninérgicas, no se liberará la suficiente para que un ISRS pueda bloquear su recaptación. Así, teóricamente habrá una desensibilización insuficiente de los autorreceptores 5HT1A somatodendríticos. A diferencia de los ISRS, cuyas acciones dependen totalmente de la liberación endógena de serotonina, la buspirona no depende de los niveles de 5HT debido a que ejerce acciones directas en los receptores 5HT1A y puede poner en marcha el proceso de desensibilización directamente. Al principio la buspirona enlentece los impulsos neuronales, lo cual puede ayudar también a la neurona a reponer sus niveles de serotonina. La buspirona actúa sinérgicamente con los ISRS.
El pindolol, otro agente potenciador de la serotonina 1 A
La idea de bloquear los autorreceptores somatodendríticos 5HT1A también es aprovechada por el pindolol, un conocido bloqueador beta-adrenérgico que es asimismo un antagonista y un agonista muy parcial de los receptores 5HT1A. Los estudios preclínicos sugieren que el pindolol puede desinhibir inmediatamente las neuronas serotoninérgicas, lo que ha hecho pensar que podría ser un antidepresivo de inicio rápido o un agente potenciador de la acción de los ISRS.
Combinaciones IMAO/ATC
Una estrategia de potenciación tradicional que en los últimos años ha caído en desuso consiste en combinar con gran cautela un antidepresivo tricíclico y un inhibidor de la monoaminooxidasa. Teniendo en cuenta sus peligros potenciales, además de la amplia variedad de otras combinaciones antidepresivas de las que hoy se dispone, esta combinación raramente es necesaria o está justificada.
Los estrógenos y las hormonas reproductivas como agentes potenciadores de los antidepresivos
Otra terapia de combinación de hormonas consiste en combinar un antidepresivo de primera línea, especialmente un ISRS, con terapia de reemplazo de estrógenos en mujeres perimenopáusicas o postmenopáusicas refractarias al tratamiento con monoterapias antidepresivas. Por desgracia, hay pocos ensayos, si es que hay alguno, que proporcionen alguna directriz acerca de cómo combinar estrógenos con antidepresivos. Numerosos informes de casos y anécdotas de la práctica clínica demuestran que algunas mujeres que responden a los estrógenos, no responden a los antidepresivos, y otras mujeres que responden a la combinación de estrógenos más antidepresivos no responden a los antidepresivos solos.
Dado que el estrógeno es en sí mismo un activador directo de la transcripción, es posible que actúa sinérgicamente en el nivel genómico con la transcripción activada por los ISRS para producir un resultado molecular mayor de que pueden producir los ISRS por si solos.
Combinaciones insomnio/ansiedad
El insomnio es una condición común comórbida con la depresión, frecuentemente empeora con los antidepresivos, en particular con los ISRS. Cuando el insomnio persiste a pesar de una evaluación adecuada y de los intentos por reducirlo con otros planteamientos, con frecuencia es necesario utilizar un sedante-hipnótico concomitante, especialmente una no-benzodiacepina de acción breve e inicio rápido. A veces puede ser necesaria una benzodiacepina hipnótica sedante. Si la ansiedad persiste durante el día y no se puede tratar de otro modo, puede ser necesario añadir una benzodiacepina ansiolítica. El uso de sedantes-hipnóticos y de ansiolíticos debería reducirse al menor tiempo posible.
Combinaciones bipolares
El tratamiento de primera línea es, o bien con litio, o bien con ácido valproico. Cuando los pacientes no se estabilizan en la fase maníaca aguda con uno de esos tratamientos de primera línea, el agente preferido como segunda opción es un antipsicótico atípico, que se están convirtiendo incluso en tratamientos de primera línea para la fase maníaca del trastorno bipolar.
Si esto tampoco resulta efectivo, se puede añadir una benzodiacepina (arma de asalto benzo) o un antipsicótico convencional (neuroléptico, arma nuclear)) a las monoterapias de primera o segunda línea, especialmente en los pacientes más perturbados. Los antipsicóticos neurolépticos se debería limitar a la fase aguda y ser administrados con moderación.
En cuanto al mantenimiento, si los estabilizadores del estado de ánimo de primera línea o los antipsicóticos de segunda línea no logran controlar suficientemente los síntomas, se puede probar terapias con anticovulsivantes (monoterapia de tercera línea) Las recomendaciones terapéuticas para el tratamiento del trastorno bipolar están experimentando cambios rápidos. Varios principios terapéuticos nuevos están guiando el tratamiento:
Los anticonvulsivantes, en particular el ácido valproico junto con el litio se consideran excelentes opciones de primera línea.
Los antipsicóticos atípicos constituyen claras opciones de segunda línea para la terapia de mantenimiento del trastorno bipolar cuando uno o más estabilizadores del ánimo, solos o en combinación no son suficientes.
En esta enfermedad los tratamientos con antidepresivos no son benignos. Aunque clásicamente se han mantenido muchos pacientes bipolares tanto con litio como con un antidepresivo, en la actualidad se reconoce que los antidepresivos frecuentemente descompensan a los pacientes bipolares, causando, no sólo manía o hipomanía manifiestas, sino también problemas de manía mixta y ciclos rápidos, que son mucho más difíciles de reconocer y tratar. Ahora, los antidepresivos se relegan a tercera línea. Se trata de una estrategia de moderación.
Un planteamiento racional de las combinaciones de antidepresivos con otros antidepresivos
En el contexto de los actuales esquemas de atención sanitaria es posible que los modernos psicofarmacólogos/psiquiatras traten exclusivamente a los pacientes resistentes a los tratamientos convencionales, ya que los casos más sencillos son tratados por los profesionales de atención primaria, mientras que los casos difíciles se remiten a los especialistas.
Diagnóstico de resistencia al tratamiento: muchos pacientes tienen problemas con los antidepresivos, y tras un ensayo con varios fármacos resulta fácil concluir que son resistentes al tratamiento. Sin embargo, antes de concluir que un paciente no responde a los antidepresivos, es necesario repasar cuidadosamente la historia del tratamiento para descartar una intolerancia a la medicación disfrazada de resistencia a la medicación. La solución de la intolerancia a la medicación puede ser la potenciación con un antidepresivo que elimine los efectos secundarios del antidepresivo que no se tolera.
La otra situación que se debe descartar al establecer la resistencia es la de diagnosticar erróneamente una depresión unipolar resistente, cuando en realidad el paciente es bipolar. Es decir, un paciente aparentemente unipolar con agitación inducida por los fármacos puede ser en realidad un paciente bipolar con ciclos rápidos o manía mixta de un trastorno bipolar no reconocido. Esta situación normalmente se exacerbará cuando se combinen dos antidepresivos. La solución a este problema puede ser interrumpir los antidepresivos y optimizar el tratamiento con estabilizadores del ánimo y antipsicóticos atípicos antes de usar un agente antidepresivo.
Principios de las combinaciones de antidepresivos: se establecen tres principios importantes:
Combinar mecanismos, no sólo fármacos. Algunos fármacos tienen un mecanismo principal, otros mecanismos múltiples. Combinar fármacos equivale a combinar tres o más mecanismos.
Favorecer la mala matemática. Una mezcla fructífera de mecanismos farmacológicos produce la sinergia farmacológica de las acciones terapéuticas de los antidepresivos (donde 1+1=10). Por otra parte, conocer el mecanismo de los efectos secundarios de los antidepresivos puede llevar a otras mezclas fructíferas de mecanismos farmacológicos donde la oposición a los perfiles de los efectos secundarios pueda favorecer la tolerabilidad (donde 1+1=0). Las mezclas más inteligentes pueden producir ambas formas de mala matemática al mismo tiempo: la potenciación de la eficacia junto con la mejora de la tolerabilidad.
Aprovechar las sinergias teóricamente importantes:
Sinergias de los sistemas monoaminérgicos serotonina, norepinefrina e incluso dopamina.
Sinergia entre la serotonina y la norepinefrina.
La sinergia en el sistema serotoninérgico: Potenciar la neurotransmisión de la serotonina ha demostrado ser útil no sólo en la depresión resistente al tratamiento, sino también en la resistencia al tratamiento característica de toda la familia de “trastornos del espectro serotoninérgico”, como el trastorno obsesivo- compulsivo, el trastorno de pánico, la fobia social, el trastorno de estrés postraumático y la bulimia.
Norepinefrina y sinergia: Potenciar la neurotransmisión noradrenérgica puede ser útil no sólo en la depresión en general, sino también en los pacientes que responden sólo parcialmente al tratamiento, sobre todo aquellos que presentan fatiga, apatía y retardo cognitivo.
La estrategia “heroica”: Potenciar la serotonina y la norepinefrina: En los pacientes más refractarios puede ser necesario usar las estrategias combinadas tanto serotoninérgica como adrenérgica (combinado heroico). Son trece combinaciones específicas que producen el mismo resultado en una u otra medida; a saber, la potenciación o la doble potenciación de la serotonina, norepinefrina e incluso la dopamina. Una de las combinaciones teóricamente más potentes es la de altas dosis de venlafaxina con mirtazapina (denominada gasolina para cohetes). Estos fármacos combinan varias sinergias que se hallan a su vez en sinergia, es decir, bloqueo de la recaptación más bloqueo alfa 2 para una doble desinhibición, y acciones en 5Ht más acciones en NE que potencian los receptores 5Ht en 5HT1A pero bloquean los receptores 5HT2A.
La clave está en utilizar combinaciones farmacológicas seguras y racionales que aprovechen las sinergias farmacológicas y moleculares esperadas mientras incluso fomentan la tolerabilidad mutua. Por desgracia, disponemos todavía de escasa documentación científica sobre el uso empírico de dichas combinaciones racionales.
Terapia electroconvulsiva
El fracaso en la respuesta a toda una serie de antidepresivos es el factor clave que indica que se debe considerar la terapia electroconvulsiva (TEC). Este el único agente terapéutico para el tratamiento de la depresión que es rápido en su inicio, pudiéndose empezar incluso después de un único tratamiento, típicamente en unos cuantos días.
El mecanismo se desconoce, pero se cree que está relacionado con la probable movilización de neurotransmisores causada por la convulsiones. La pérdida de memoria y la estigmatización social son los principales problemas asociados a la TEC y limitan su uso.
La TEC resulta especialmente útil cuando se desea un inicio rápido de los efectos clínicos y cuando los pacientes son refractarios a diversos fármacos antidepresivos. También resulta de gran utilidad en la depresión psicótica y bipolar, así como en la psicosis posparto. Si se pudiera desentrañar el mecanismo de acción terapéutica de la TEC, sería posible encontrar un nuevo fármaco antidepresivo capaz de producir un inicio rápido de los efectos antidepresivos o que resultara de especial valor en los pacientes refractarios al tratamiento.
Psicoterapia
En los últimos años, la moderna investigación en psicoterapia ha empezado a estandarizar y a probar psicoterapias concretas de manera análoga al modo como se prueban los fármacos antidepresivos en los ensayos clínicos. Así, hoy las psicoterapias se están aplicando de acuerdo a protocolos estándar por psicoterapeutas que reciben formación estandarizada y utilizan manuales estándar, y usando también “dosis” estándar durante períodos preestablecidos.
Estos usos de las psicoterapias se están comparando en ensayos clínicos con placebos y antidepresivos.
Los resultados han mostrado:
Algunos pacientes con depresión la terapia interpersonal y la terapia cognitiva pueden ser tan eficaces como los propios antidepresivos.
La nefazodona cuando se combina con terapia cognitivo-conductual es particularmente eficaz
Psicoterapia interpersonal y ATC
Psicoterapia interpersonal y nortriptilina especialmente cuando se observan resultados a largo plazo.
La psicoterapia cognitivo-conductual puede resultar valiosa como complemento de los antidepresivos en el tratamiento de la ansiedad.
Se desconoce si añadir la psicoterapia a los pacientes que responden a los antidepresivos pero que no presentan una remisión completa podría conducir a la remisión y a la recuperación, pero se trata de una posibilidad interesante.
Dado que los actuales esquemas de la atención sanitaria reducen la disponibilidad de la psicoterapia, los profesionales de la salud mental están pasando a depender cada vez más del planteamiento psicofarmacológico. La demostración científica del beneficio de la psicoterapia complementaria, en rápida evolución, debería proporcionar una justificación anhelada y necesaria, mostrando quién se beneficia de qué tipos de psicoterapia combinados con qué antidepresivos concretos.